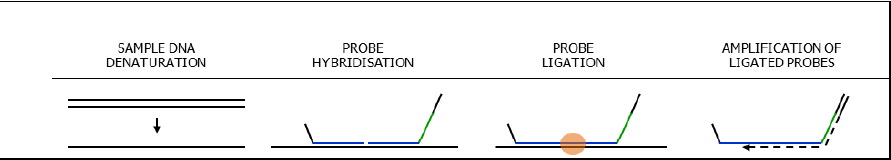
2 Coffalyser.Net začíná analýzu ze syrových dat (korekce základny/baseline, identifikace píků) a provádí rozsáhlou kontrolu kvality (například použité množství DNA; kompletní DNA denaturace, stupeň šikmosti). Korekce sklonu píků je jednou z mnoha možností.
3 Standardní odchylka se liší u každé sondy a závisí na mnoha faktorech, včetně 1. kvality vzorků DNA (čistota; fragmentace DNA, depurinace, další úpravy); 2. množství použitého vzorku DNA; 3. počet a kvalita referenčních a pozitivních vzorků; 4. experimentální podmínky (například přesnost pipetování, rovnoměrnost teploty v termocykleru, kvalita separace a detekce amplikonů); 5. metoda použitá pro analýzu dat. Coffalyser.Net vyhodnocuje všechny tyto faktory.
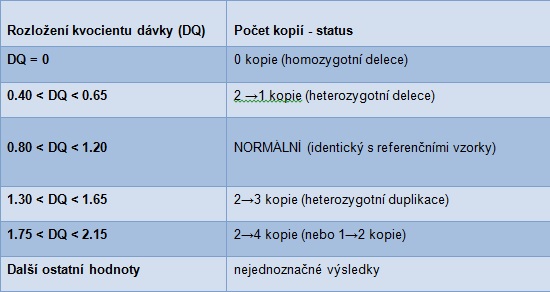
4 Coffalyser.Net používá hodnoty 0,7 a 1,3 jako cut-off hodnoty pro heterozygotní delece nebo duplikace (při normálním diploidním stavu). Coffalyser.Net tak používá ostré cut-off hodnoty, zatímco Tabulka 1 udává podstatně nejednoznačný rozsah DQ pro mozaiky a nádorové vzorky, 0,7 / 1,3 cut-off hranice nejsou použitelné, neboť DQ může mít jakoukoliv hodnotu: výpočet DQ bude záviset na a) velikosti změny počtu kopií a b) procentu různých typů buněk v DNA vzorku. Jelikož Coffalyser.Net určuje významné změny signálu sond vyhodnocením velikosti vypočteného DQ v kombinaci s jeho statistickou významností v experimentu, proto částečná změna počtu kopií může být ještě rozpoznána, pokud a) experiment byl proveden stejně, a b) podobný DQ byl získán u sousedních sond.
5 Příklad: Ve vzorku A - 30% jeho buněk obsahuje 3 kopie chromozómu 21, 70% obsahuje 2 kopie. DQ nalezený pro sondy Chr. 21 bude: (30% x 3) + (70% x 2) / 2 * = 1,15 (2 *: počet kopií přítomných v referenčních vzorcích)
6 Při navrhování sond známé SNP jsou eliminovány, pokud je to možné. Nicméně, nové SNP jsou neustále objevovány. Prosím, dejte nám vědet, pokud polymorfismus nebo časté patogenní mutace ovlivňují signál sondy.
7 Schwartz M. a Duno M. (2004). Improved molecular diagnosis of dystrophin gene mutations using the multiplex ligationdependent probe amplification method. Genet Test. 8:361-7.